010-88508238
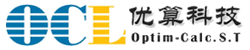
支持多种数据采集方式,实时数据录入与验证,大幅提高临床试验数据采集效率和质量。
内置强大的数据验证规则,实时检查数据完整性和一致性,确保临床试验数据质量。
符合FDA 21 CFR Part 11、GCP等法规要求,提供完整的审计追踪和电子签名功能。
支持多中心临床试验数据管理,实现研究中心之间的高效协作和数据共享。
提供实时数据监控和分析功能,帮助研究者及时掌握试验进展和数据质量。
支持灵活的eCRF设计和临床试验流程配置,满足不同类型临床试验的需求。
提供直观易用的eCRF设计工具,支持多种字段类型和复杂表单逻辑,满足不同临床试验的数据采集需求。
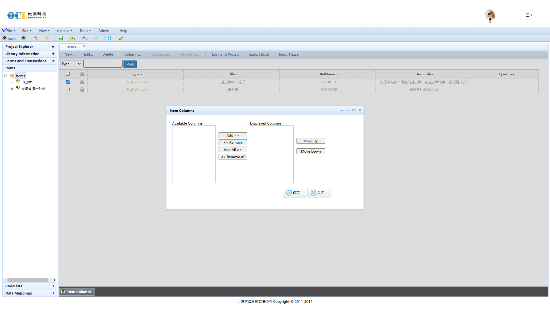
提供全面的数据质量管理功能,包括数据验证、查询管理和医学编码,确保临床试验数据准确可靠。
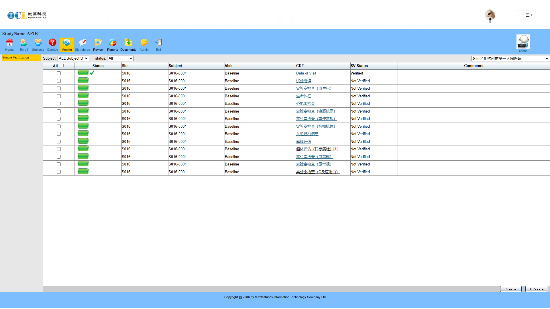
支持多中心临床试验的集中管理,提供研究中心管理、用户权限控制和数据安全保护功能。
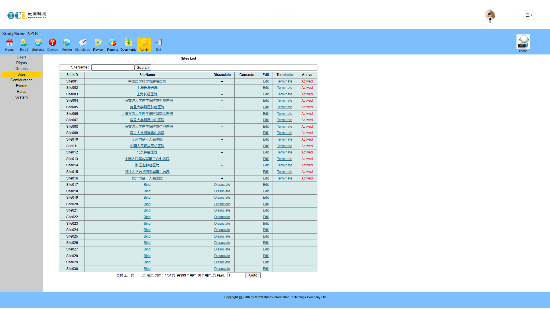
完全符合FDA 21 CFR Part 11电子记录和电子签名法规要求。
遵循ICH-GCP指导原则,确保临床试验的科学性和伦理性。
采用先进的数据加密和安全措施,保护临床试验数据安全。
完整的审计追踪功能,记录所有数据变更和系统操作。
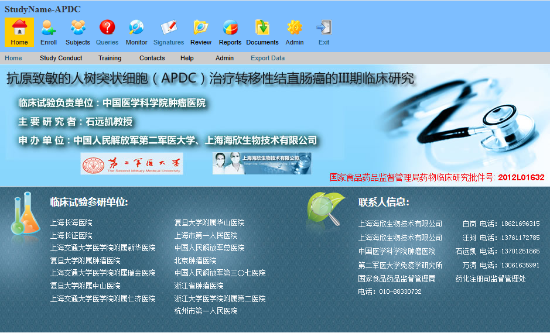
使用EDC系统后,临床试验数据采集效率提升50%,数据质量显著提高,新药上市时间缩短6个月。
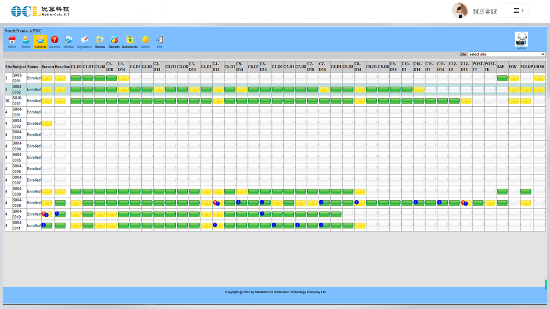
通过EDC系统管理多个国际多中心临床试验,数据管理成本降低30%,客户满意度提升至95%。
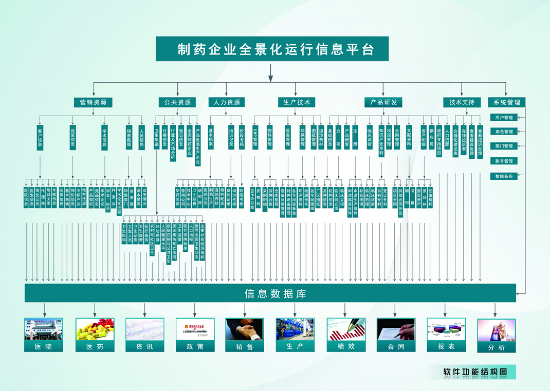
引入EDC系统后,研究者数据录入时间减少60%,数据核查效率提升70%,研究质量显著提高。